T.E.L: 5 min. 53 seg.
¿Qué es y cómo está compuesto el espectro electromagnético? ¿En cuántos colores se divide la luz visible? ¿Qué es el añil o índigo?. Más que una nota de divulgación, bien podríamos decir que esta es una nota de color.

Espectro electromagnético
Se llama así a la distribución energética del conjunto de las ondas electromagnéticas.
El espectro electromagnético se extiende desde la radiación de menor longitud de onda, como los rayos gamma y los rayos X, pasando por la luz ultravioleta, la luz visible y los rayos infrarrojos, hasta las ondas electromagnéticas de mayor longitud de onda, como son las ondas de radio.
Para estudiar los espectros de luz de un objeto se utilizan los espectroscopios.

Diagrama del espectro electromagnético, mostrando el tipo, longitud de onda (con ejemplos), frecuencia y la temperatura de emisión de cuerpo negro. Wikipedia, adaptada de NASA
La espectrocopía es una herramienta muy importante en astronomía. Es un detallado estudio de la luz de objetos distantes. La luz es energía que se mueve a través del espacio y puede ser pensada tanto como una onda o como una partícula. La distancia entre los picos de las ondas es su longitud. La luz está hecha de diferentes longitudes. Por ejemplo, la luz visible tiene una longitud de un décimo de un micrómetro.
Los espectómetros son instrumentos que separan la luz en sus longitudes creando un espectro. Así los astrónomos pueden estudiar las líneas de emisión y absorción que son las huellas de los átomos y moléculas. Una línea de emisión ocurre cuando un electrón cae a una órbita más baja alrededor del núcleo de un átomo y pierde energía. Una línea de absorción ocurre cuando los electrones se mueven a una órbita superior al absorber energía. Cada átomo tiene una determinada cantidad de espacio en sus órbitas y puede emitir o absorber sólo ciertas energías o longitudes. Por eso, la localización y espaciado de las líneas espectrales es única para cada átomo.
Los astrónomos pueden saber mucho de un objeto en el espacio al estudiar su espectro, como su composición, temperatura, densidad y movimiento.
Hay tres tipos de espectro que un objeto puede emitir: continuo, de emisión o de absorción. A continuación hay tres ejemplos para la luz visible, pero el concepto es el mismo para cualquier región del espectro electromagnético.
Espectro continuo
También llamado termal o espectro de cuerpo negro. Es emitido por un objeto que radia calor. La luz es dispersada en una banda continua con cada longitud con la misma cantidad de radiación. Por ejemplo, cuando la luz del sol es pasada por un prisma, su luz es dispersada en sus colores.
Espectro de absorción
Si miramos en detalle, muy de cerca, el espectro del Sol, notaremos la presencia de líneas oscuras. Esas líneas son causadas por la atmósfera del sol que absorbe luz a ciertas longitudes, causando que la intensidad de la luz en esas longitudes caiga y aparezca oscuro. Los átomos y moléculas en un gas absorberán sólo ciertas longitudes de onda de luz. El patrón de estas líneas es único para cada elemento y nos dice qué elementos forman la atmósfera del Sol. Los astrónomos ven espectros de absorción de regiones del espacio donde un gas más frío yace entre nosotros y una fuente más caliente, en estrellas, planetas con atmósferas y galaxias.
Imagen detallada del espectro visible de nuestro Sol.
El espectro de absorción del hidrógeno, elemento más abundante en el sol.
Espectro de emisión
Ocurre cuando los átomos y moléculas en un gas caliente emiten luz extra a ciertas longitudes, causando que líneas brillantes en el espectro. Como en el caso anterior, son líneas únicas para cada elemento. Podemos ver líneas de emisión de cometas, nebulosas y ciertos tipos de estrellas.
El espectro de emisión del hidrógeno.
En la práctica, los astrónomos no suelen mirar a los espectros en la forma que se mostró en las imágenes anteriores. En cambio estudian los gráficos de intensidad, señal o flujo versus longitud de onda. Estos gráficos muestran cuánta luz es presente o ausente en cada longitud. Un pico en el gráfico muestra la posición de una línea de emisión y una depresión muestra dónde están las líneas de absorción. El espaciado y localización de estas líneas son únicas para cada átomo y molécula.
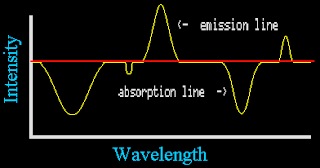
La forma de un espectro continuo en un gráfico depende de la temperatura y movimiento del gas. En este gráfico simple se muestra como una línea plana -en realidad es usualmente una línea curva. También, muchos de los gráficos de datos reales mostrarán la longitud o frecuencia en una escala logarítmica.
Los colores del espectro visible

Diagrama de Espectro electromagnético con detalle del espectro visible.
Lo que se muestra es todo el espectro (desde los rayos gamma pasando por los rayos-X, ultravioleta, microondas y radio) con su correspondientes rangos de longitud de onda en metros y frecuencia (Hz).
La parte visible es una pequeña porción entre el ultravioleta y el infrarrojo.
Arriba de esa línea hay un detalle ampliado del espectro visible en el que cada color tiene un rango en nanometros.
Para medir estas longitudes se usó (y todavía se usa) el ångström, pero en el Sistema Internacional de Medidas se usa el nanometro o nanómetro (nm).
1 nm= 1x10-9 metros y 1 nm = 10 Å.
En la imagen superior vemos que el rojo del espectro visible se extiende entre los 620-750 nm; el naranja en 590-620; amarillo en 570-590; verde en 495-570; azul 450-490 y violeta 380-450 nm.
El gran Isaac Newton demostró que la luz blanca estaba formada por una banda de colores (rojo, naranja, amarillo, verde, azul y violeta) que podían separarse por medio de un prisma.
¿Podemos distinguir estos seis colores en el gráfico del espectro de luz visible anterior?
El color de Newton
Ahora bien, Newton incluyó además el color índigo o añil en la banda de los 450-477 nm. ¿Por qué? Porque en aquella época se conocían sólo siete planetas. Y porque la numerología (y la astrología, así como la alquimia) tenían una fuerte influencia en el pensamiento de la época. Así, parecía que si el espectro fuese de siete colores habría simetría con el número de planetas, notas musicales, días de la semana y muchas otras concurrencias del número siete en la cultura universal y en la Biblia.

Diagrama de Newton de un círculo con los colores del espectro, planetas y notas musicales. Hay que notar que en el sistema musical inglés, las notas (do re mi fa sol la si, se representan con las letras A B C D E F G)
Los espectros de absorción y emisión de los elementos, online
En el sitio Educaplus.org hay una página sobre la luz y sus propiedades con un simulador de espectros en el que podemos ir pasando de los elementos más livianos a los más pesados y representando sus espectros.
La divina proporción de Balmer
En 1885, Johann Jacob Balmer descubrió una sencilla fórmula matemática que relacionaba las longitudes de onda de las líneas en el espectro visible y en el cercano al ultravioleta del gas hidrógeno.
En "Una historia sentimental de las ciencias", libro de Nicolas Witkowski que reseñé en "Los sentimientos científicos", figura la historia de Balmer en el capítulo "La fórmula mágica de Jacob Balmer".
Allí se cuenta que Balmer, un maestro de escuela suizo, cuando se renovaba una vieja iglesia en Basilea, se entregó al estudio de las proporciones del sagrado edificio. Las relaciones (anchura por altura, anchura por longitud y longitud del coro por longitud de la nave) son 2:7, 3:7 y 5:9. Un amigo suyo, a la par, lo había introducido en un enigma matemático-físico: el espectro del hidrógeno está constituido por cuatro rayas luminosas. ¿Qué regla hay detrás de eso? Numéricamente, estas rayas están a 6.562, 4.860, 4.340 y 4.101 que representan las longitudes de onda de luz visible emitidas por el hidrógeno en cien millonésimos de centímetro.
Balmer relaciona ambas cosas: las proporciones de la iglesia y las líneas de emisión. Si a la mayor longitud se le aplica la relación 5:9 encontrada en la iglesia se obtiene 3.645. Con este número se pueden establecer las otras tres longitudes de onda. Así, 3645 multiplicado por 9/5, 16/12, 25/21 y 36/32 se llega a las longitudes buscadas:
3.645*9/5=6561; 3.645*16/12=4860; etc.
Y eso no es todo: 9/5 (o 9:5) es igual a 9:9-4, o lo que es lo mismo
32:32-22
y lo mismo con las demás:
42:42-22 (16:12)
52:52-22 (25:21)
62:62-22 (36:32)
Y algo más: 6.562:4.101 es casi casi 8:5. Un número dorado para un rayo de luz!
Más en Wikipedia: Líneas de Balmer
En 1885, Johann Jacob Balmer descubrió una sencilla fórmula matemática que relacionaba las longitudes de onda de las líneas en el espectro visible y en el cercano al ultravioleta del gas hidrógeno.
En "Una historia sentimental de las ciencias", libro de Nicolas Witkowski que reseñé en "Los sentimientos científicos", figura la historia de Balmer en el capítulo "La fórmula mágica de Jacob Balmer".
Allí se cuenta que Balmer, un maestro de escuela suizo, cuando se renovaba una vieja iglesia en Basilea, se entregó al estudio de las proporciones del sagrado edificio. Las relaciones (anchura por altura, anchura por longitud y longitud del coro por longitud de la nave) son 2:7, 3:7 y 5:9. Un amigo suyo, a la par, lo había introducido en un enigma matemático-físico: el espectro del hidrógeno está constituido por cuatro rayas luminosas. ¿Qué regla hay detrás de eso? Numéricamente, estas rayas están a 6.562, 4.860, 4.340 y 4.101 que representan las longitudes de onda de luz visible emitidas por el hidrógeno en cien millonésimos de centímetro.
Balmer relaciona ambas cosas: las proporciones de la iglesia y las líneas de emisión. Si a la mayor longitud se le aplica la relación 5:9 encontrada en la iglesia se obtiene 3.645. Con este número se pueden establecer las otras tres longitudes de onda. Así, 3645 multiplicado por 9/5, 16/12, 25/21 y 36/32 se llega a las longitudes buscadas:
3.645*9/5=6561; 3.645*16/12=4860; etc.
Y eso no es todo: 9/5 (o 9:5) es igual a 9:9-4, o lo que es lo mismo
32:32-22
y lo mismo con las demás:
42:42-22 (16:12)
52:52-22 (25:21)
62:62-22 (36:32)
Y algo más: 6.562:4.101 es casi casi 8:5. Un número dorado para un rayo de luz!
Más en Wikipedia: Líneas de Balmer
Nota escrita para el VI Carnaval de la física, en esta edición hospedado por este blog. Para unirse y leer las entradas existe una red social en Ning.


Fuentes y links relacionados
Sobre las imágenes
Etiquetas:
Astronomía en Blogalaxia-Ciencia en Bitácoras.com


No hay comentarios.:
Publicar un comentario